Kimyasal Denge

Kapalı bir kapta sabit sıcaklıkta gerçekleşen çift yönlü re- aksiyonlara denge reaksiyonu denir. Denge reaksiyonla- rı dinamiktir.
fiziksel denge
Kapalı bir kaba su konulduğunda, yüzeydeki ve enerjileri yeterince büyük olan moleküllerin bir kısmı gaz haline geçer. Bu olaya buharlaşma denir.
Gaz haline geçen taneciklerin bir kısmı yeniden sıvı faza döner. Bu olaya da yoğunlaşma denir.
Belli bir süre sonra buharlaşan moleküllerle yoğunlaşan moleküllerin hızları birbirine eşit olur. Böylece sıvı – bu- har dengsi kurulur.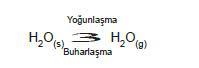
Bu olay bize fiziksel dengenin varlığından bahseder
Kimyasal Tepkimelerde Denge
bazı kimyasal tepkimeler tepkimeye giren maddelerin ta- mamı ürünlere dönüşene kadar devam eder. Bu tip tep- kimelere tek yönlü tepkimeler denir.
X(g) + Y(g) Æ Z(g) + L(g)
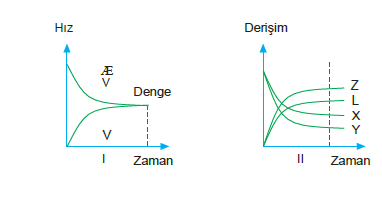
Denge tepkimelerinde girenler hiçbir zaman tamamen ürünlere dönüşemez. Denge tepkimelerinde hem ileri, hem de geri tepkime hızından bahsedilir. Bir tepkimede ileri tepkime hızı geri tepkime hızına eşit olduğu anda denge kurulur.
X(g) + Y(g) 3 Z(g) + L(g)
Çift yönlü ok tepkime kabında hem ileri tepkime hem de geri tepkimenin gerçekleştiğini gösterir.
İleri tepkime hızı : THileri = k1[X].[Y] Geri tepkime hızı : THgeri = k2[Z].[L]
dengeye ulaşmış tepkimede ileri tepkime hızı geri tepki- me hızına eşit olacağından