Kimyasal Tepkimelerde Enerji

Doğadaki ve evrendeki bütün maddelerin İçlerinde mad- denin yapısına ve miktarına göre az veya çok enerji de- po edilmiştir. Bu enerjiye o maddenin ısı kapsamı veya entalpisi denir.
Isı kapsamı sistemin içinde var olan bütün enerji şekille- rinin toplamıdır. Bu enerjilerin bir kısmı potansiyel, bir kısmı kinetik türde olabilir.
Tepkime Entalpisi
Tepkime entalpisi ΔH ile gösterilir. Birimi kalori(kal) veya kilokalari (kkal) dır. Tepkimelerde kullanılan ya da açığa çıkan enerji olarak ifade edilir.
Standart şartalarda elementlerin oluşma entalpileri sıfır kabul edilir.
NOT: Eğer tepkimeye girenler ve ürünler standart koşullar-da ise (1 Atm, 25°C) ΔH° ile belirtilir ve buna “stan- dart tepkime entalpisi” denir.
Kimyasal tepkimelerde, ürünlerin entalpileri ile girenlerin entalpileri arasındaki farka tepkime entalpisi denir.
ΔH = S ΔHÜ – S ΔHG bağıntısıyla yazılır. Tepkime entalpisine (ΔH) etki eden faktörler,
1. Sıcaklık
2. Basınç
3. Fiziksel hal
4. madde miktarı
ÖRNEK: Aşağıda üç bileşiğin elementlerinden oluşma ısıları
verilmiştir.
C3H8(g) ΔH = –24,8 kkal/mol CO2(g) ΔH = –94,0 kkal/mol H2O(g) ΔH = –57,8 kkal/mol
Buna göre, C3H8(g) in H2O(g) ve CO2(g) vermek üzere yanma ısısı (ΔH) kaç kkal/mol dür?
A) –176, 6 B) –231, 2 C) –282,0 D) –488,4 E) –538,0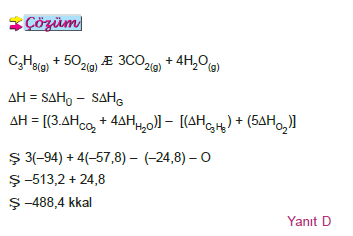
Endotermik Tepkimeler
Tepkimeye girenlerin oluşma entalpileri toplamı, ürünlerin oluşma entalpilerinden küçük ise en az aradaki fark kadar enerji gerekmektedir. Bu şekilde ısı alan tepkimelere endotermik tepkimeler denir.
Endotermik tepkimelerde ΔH ın işareti pozitif (+) olur.
X + Y Æ Z + R ΔH = + ısı Enerji, tepkime denkleminde,
X + Y + ısı Æ Z + R şeklinde gösterilir.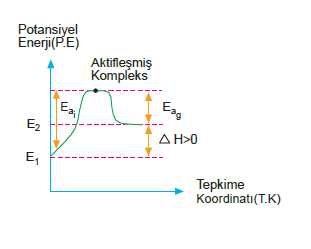
E1 : Girenlerin potansiyel enerjileri toplamı
E2 : Ürünlerin potansiyel enerjileri toplamı
Ea : ileri tepkimenin aktifleşme enerjisi
Ea : Geri tepkimenin aktifleşme enerjisi
Ekzotermik Tepkimeler
Tepkimeye girenlerin oluşma entalpileri toplamı, ürünlerin oluşma entalpileri toplamından büyük ise aradaki fark kadar enerji dışarıya verilir. Böyle tepkimelere ekzotermik (ısı veren) tepkimeler denir.
Tepkime dışarıya ısı verdiği için ΔH işareti negatif (–) olur.
X + Y Æ Z+R ΔH = – ısı Enerji, tepkimen denkleminde, X + Y Æ Z + R + ısı şeklinde gösterilir.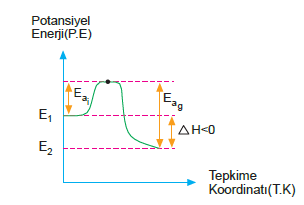

NOT: Düşük sıcaklıkta endotermik tepkimelerde girenler, ekzotermik tepkimelerde ürünler daha kararlıdır.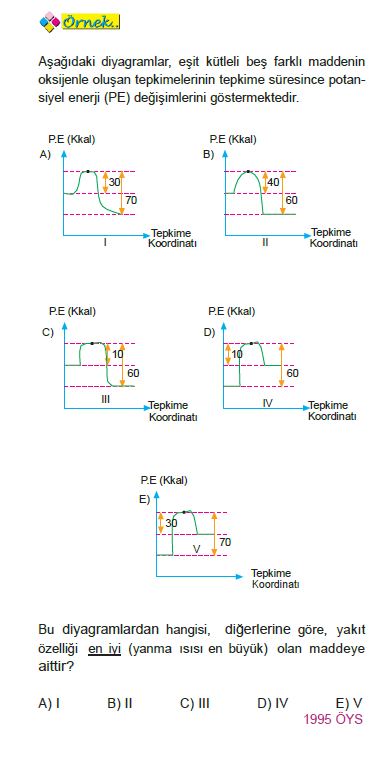
ÇÖZÜM: Ürünlerin enerjileri, girenlerin enerjilerinden daha düşük olduğundan I, II ve III tepkimeler ekzotermiktir. IV ve V tepkimeler endotermiktir ve yakıt özelliği göstermezler. Buna göre, ekzotermik tepkimeler arasından en fazla ısı veren III olduğundan buradaki madde en iyi ya-
kıttır.
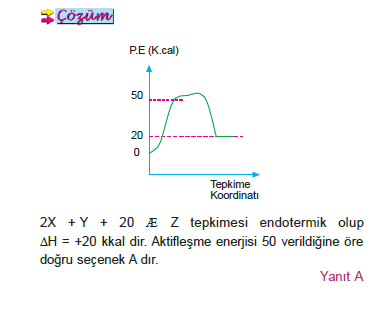
Yanıt C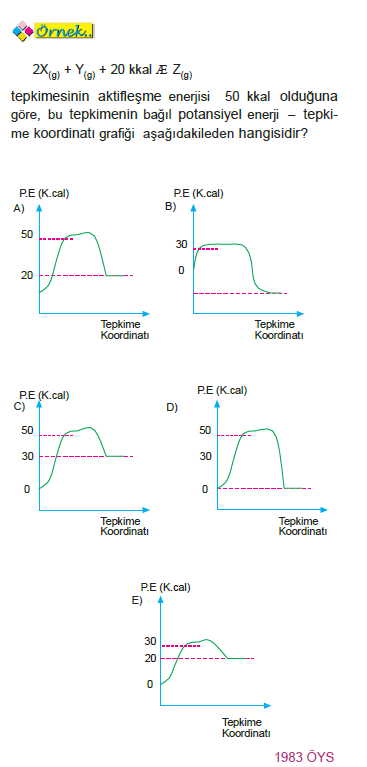
Kalorimetre Kabı ve Tepkime Isısının Ölçülmesi
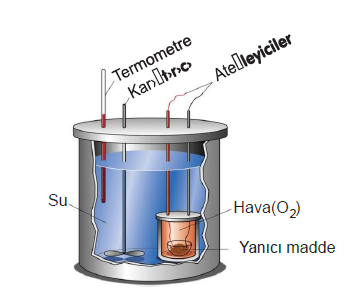
Bir çok tepkimenin ısısı, yukarıdaki kalorimetre kabına benzer bir sistem ile ölçülür. Tepkime kabında oluşan tepkime ısı verir veya alır.
Tepkimenin ısı değişimi kap ve suya geçer ve Δt kadar sıcaklık değişimi olur.
Tepkimenin ısı değişimine Q kal,
Yanan C2H6 nın verdiği ısı = Kabın aldığı ısı + Suyun aldığı ısı
Q = 400.0,2.11,8 + 500.1.11,8
Q = 6844 kal = 6,844 kkal
1 mol C2H6 30 gramdır.
kabın ısı değişimine m1.c1.Δt,
suyun ısı değişimine m2.c2.Δt dersek,
Q = Qkap + Qsu
Q = m1c1Δt + m2c2Δt m1 = Kabın kütlesi (g)
c1 = Kabın yapıldığı maddenin özısısı (kal/g°C)
m2 = Suyun kütlesi
c2 = Suyun özısısı (1 kal/g°C)
Δt = Sıcaklıktaki değişme miktarı
