Koordine Kovalent Bağ
Bağ elektronlarının her ikisi de aynı atom tarafından sağlanıyorsa bu tip bağlara koordine kovalent bağ denir.Çok atomlu iyonlarda koordine kovalent bağ görülür.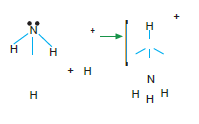
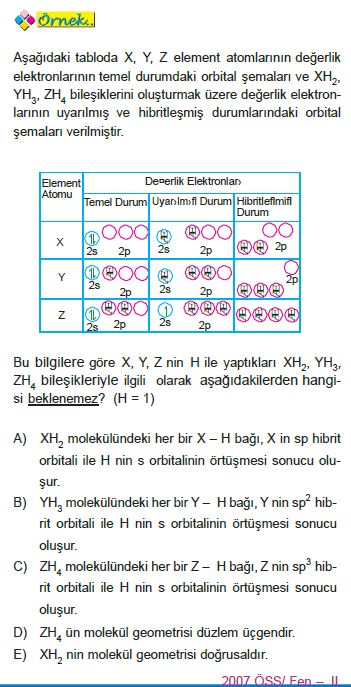

moleküller arası bağlar
Molekülleri bir arada tutan kuvvetlere moleküller arası bağlar denir.
Maddelerin erime ve kaynama noktaları, iletkenlikleri, sertlikleri gibi fiziksel özellikleri tanecikler arası kuvvetlere bağlıdır.
a. Van der Waals Kuvvetleri
Katı ve sıvı fazda polar, apolar tüm moleküller arasında görülür. En zayıf çekim kuvvetleridir.
Apolar molekülleri bir arada tutan kuvvet yalnızca Van der Waals kuvvetleridir.
Soygazlarda (He, Ne, Ar….), molekül yapılı elementlerde (O2, N2, H2….) ve apolar moleküllerde (CH4, CCI4, BH3….) yalnızca Van der Waals kuvvetleri etkindir.
Van der Waals kuvvetinin büyüklüğü elektron sayısına, molekülün büyüklüğüne ve yapısına bağlıdır.
Molekül kütlesi arttıkça Van der Waals kuvvetleri artar. Molekül kütlesi aynı olan moleküllerden temas yüzeyi
büyük olanda Van der Waals kuvvetleri küçük olana göre daha fazladır.
Molekülde dallanma arttıkça Van der Waals kuvvetleri zayıflar.
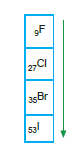
Yukarıdaki bileşiklerden 1. kaynama noktası, 2. ye göre daha büyüktür. (Aynı ortamda) 7A grubunda bulunan elementlerden F2
oda koşularında gaz, Br2 sıvı, I2 katıdır. Aynı grupta aşağı doğru molekül
kütlesi arttığı için Van der Waals kuvvetleri artar.
b. Dipol – Dipol Etkileşimleri
Polar moleküllerde, moleküller arasında görülür. Polar moleküllerde, atomların bağ elektronlarını çekim gücü farklıdır.
Bu tür moleküllerde kısmi negatif (–) ve kısmi pozitif (+) uçlar oluşur. Molekülün (+) ucu ile (–) ucu arasında elekt- rostatik çekim gücü ile oluşan etkileşime dipol – dipol etkileşimi denir.
Dipol – dipol etkileşimleri Van der Waals kuvvetlerine gö- re daha güçlüdür. Mol kütlesi aynı olan iki molekülden polar olanın kaynama noktası aynı ortamda apolar ola- nın kaynama noktasından büyüktür.
HCI, H2S, SCI2 gibi moleküllerde dipol – dipol etkileşimi vardır.![]()
c. Hidrojen Bağları
Hidrojen atomu, F, O, N gibi elektronegatifliği büyük olan bir atoma bağlı ise moleküller arasında hidrojen bağı oluşur.
H atomu H – F, N – H, O – H bağı oluşturduğu mole- küllerde etkin (+) yük kazanır. (+) yük kazanan H moleküldeki (–) ucu çeker.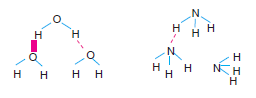
H2O, NH3, HF, C2H5OH, CH3OH gibi moleküllerde mole- küller arasında hidrojen bağı oluşur.
Aralarında hidrojen bağı oluşturan sıvı maddeler birbiri içinde iyi çözünür
Örneğin,
CH3OH ve H2O gibi
Hidrojen bağı dipol – dipol etkisi ve Van der Waals kuv- vetlerine göre daha güçlü, kovalent bağdan ise zayıftır.
Hidrojen bağı içeren bir molekülde dipol – dipol etkileşi- mi ve Van der Waals kuvvetleri de görülür.
d. Metalik Bağ
Metal atomlarını bir arada tutan kuvvetlerdir. Metallerde ve alaşımlarda görülür. Metallerin iyonlaşma enerjileri düşük olduğundan değerlik elektronları çekirdek tarafından zayıf kuvvetle çekilir. Değerlik elektronları kendi boş değerlik orbitallerinde ve komşu atomların değerlik orbitallerinde serbest hareket eder.
Değerlik elektronunu komşu atoma veren metal atomu (+) yüklü metal iyonuna dönüşür. (+) yüklü tüm metal atomları bir elektron dizisi içinde düzenli bir şekilde dizilmiştir.
Metalik bağ kuvveti aynı grupta aşağıdan yukarıya doğru, aynı periyotta soldan sağa doğru artar.
