Denge Sabitinin Değişimi (Dengede Hess Prensibi)
- Bir denge reaksiyonu ters çevrilirse K denge sabiti, çarpmaya göre tersine döner. Kd/K= 1 olarak alınır.
- Bir tepkimenin katsayıları n ile çarpılırsa, K nın “n”in- ci kuvveti alınır. Kd = K üzeri n
- Herhangi bir tepkime diğer tepkimelerin toplamın- dan oluşuyorsa, bu tepkimenin K denge sabiti diğer tepkimelerin denge sabitlerinin çarpımına eşittir. Kd = K1.K2.K3…

Dengeye Etki Eden Faktörler
Dengede bulunan bir sisteme dışarıdan bir etki yapılırsa sistemin dengesi bozulur. Bozulan dengenin yeniden oluşması için sistem dış etkiye zıt yönde bir tepki göste- rir. Yani bir denge sistemi, dışarıdan yapılan etkiyi azlta-cak biçimde davranır.
Bu ilke Le Chatelier ilkesi olarak bilinir.
Dengeyi bozan etkiler, dengedeki maddelerin, derişimle- rindeki değişmeler ile sıcaklık, basınç ve hacimdeki değişmelerdir.
Derişim Etkisi
A(g) + B(g) 3 C(g) + D(k)
dengesini örnek olarak ele alalım. Denge anında A, B, C ve D maddelerinin sabit miktarları vardır. Kap içine bir miktar A(g) eklendiğinde derişim dengeyi bozar ve sistem bunu azaltmaya çalışır. Sıcaklık ve hacim sabit tutulursa, eklenen A(g) nın bir kısmı mevcut B(g) ile birlşip C(g) ve D(k) ye dönüşür. Böylece denge ürünler lehine kayar, C(g) nin derişimi artar. Katı olduğundan ortama D(k) ekleyip veya uzaklaştırmanın dengeye hiç bir etkisi yoktur.
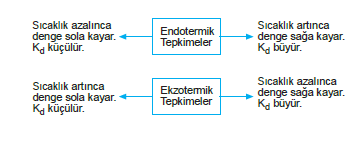
Sıcaklık Etkisi
Endotermik tepkimelerde sıcaklık artınca denge ürünler yönüne kayar.
2NO2(g)+ 13,9 kkal 3 N2O4(g)
Aynı zamanda sıcaklık Kd değerine de etki eder. Sıcaklık artırılırsa Kd değeri de artış gösterir.
Ekzotermik tepkimelerde sıcaklık azalırsa denge ürünler yönüne kayar.
N2O4(g) Æ 2NO2 + 13,9 kkal
Ekzotermik tepkimede sıcaklık artırılırsa Kd değeri azalır. Sıcaklığın denge sabitini ve dengeyi nasıl etkilediğini aşağıdaki şema ile açıklayalım.
Basınç – Hacim Etkisi
Basınç ve hacim değişmesi dengede gaz fazında bulu- nan maddelerin derişimlerini değiştirir.
A2(g) + 2B2(g) 3 2AB2(g)
denge sisteminde kabın hacmi veya basıncı değişince denge bozulur. Fakat,
AgCl(k) 3 Ag (suda) + Cl (suda)
dengesine basıncın etkisi yoktur, ancak hacim değişikliği etkilidir
N2(g) + 3H2(g) 3 2NH3(g)
tepkimesinde kabın hacmini küçültelim. Hacim küçülmesi basınç arttıracağından sistem dengeye gelmek için basıncı azaltmak isteyecektir.
Bu nedenle basıncın azalması için sistem, gaz mol sayısının az olduğu tarafa kayar. Yani sistem ürünlere kayar. Girenlerde ve ürünlerde gaz mol sayısı eşitse hacim ve basınç sisteme etki etmez.
Buna göre, buradan çıkacak sonuç,
1. Basınç artırılırsa, denge gaz mol sayısının toplamının az olduğu yöne,
2. Basınç düşürülürse, denge gaz mol sayısının toplamı- nın çok olduğu yöne kayar.
ÖRNEK: Pistonlu kapta,
H2O(s) 3 H2O(g)
denge tepkimesinde diğer koşullar sabit tutularak,
I. Hacmi küçültme
II. Sıcaklığı yükseltme
III. Kaba H2O(s) katma
işlemlerinden hangileri uygulanırsa dengenin H2O(g)
yönüne kayması beklenir?
A) Yanız I B) Yalnız II C) I ve III D) II ve III E) I, II ve III
1997 ÖYS
ÇÖZÜM: I. hacmi küçülttüğümüzde basınç arttırmış oluruz. Sistem basıncın azalması yönünde hareket edeceğinden gaz mol sayısının az olduğu yere yani H2O(s) yönüne hareket eder.(yanlış)
II. Sıvıdan gaza geçiş endotermik bir olay olduğuna gö- re, sıcaklığı yükseltme sistemi ürünler yönüne (H2O(g)) kaydırır. (doğru)
III. Saf katı ve sıvıların derişiminden bahsedilemeyece-
ğinden, kaba H2O(s) katılması dengeyi etkilemez.(yanlış)
Yanıt B
[kimya_ygs_lys]
