Çözelti Derişimleri
Çözeltideki çözünmüş madde oranına derişim denir. Çe- şitli ifadeleri vardır.
a. Yüzde Derişim (Konsantrasyon)
100 gram çözeltide çözünmüş maddenin kütlece miktarıdır.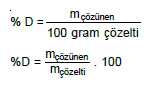
ÖRNEK: 90 gram suya 30 gram X eklenerek hazırlanan çözelti yüzde kaçlıktır?
% D = 30/90 + 30 x 100 =%25
b. Molar Derişim (Molarite)
1 Litre çözeltide çözünmüş maddenin mol miktarıdır.
M=m/v Birimi mol/L ya da M (molar) dır.
Çözeltinin özkütlesi bilindiğinde % konsantrasyonla birlikte derişimi,
M = 10. %C. dçözelti/MA çözünen eşitliği ile bulunabilir
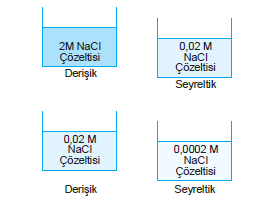
Seyreltik ve Derişiklik
Çözeltiler derişim yönünden karşılaştırıldığında, derişimi düşük olan seyreltik, yüksek olan derişik çözelti olarak nitelendirilir.
c. İyon Derişimi
Suda iyonlaşarak çözünen maddeler formüllerindeki iyon sayısı kadar iyon derişimi oluştururlar.
AlCl3 Æ Al + 3Cl– 2M 2M 6M
İyon derişimi köşeli parantezle belirtilir, [ ].
Al+3] = 2M [Cl–] = 6M Mtoplam = 8 M
Çözeltideki toplam iyon derişimi 8 M dır.
ÖRNEK: 0,3 M, 2 L AlCl3 çözeltisi ile 0,1 M 3L CaCl2 çözeltisi karıştırılıyor. M = 2 Molar olur.
Karışımdaki iyonların derişimlerini hesaplayınız.
ÇÖZÜM:
d. Normal Derişim (Normalite)
N = M.e
e = etki değeri
Birimi N (normal) dir. Asitler için e, H+ sayısı Bazlar için e, OH– sayısı tuzlar için e, toplam katyon veya anyon yüküdür.
ÖRNEK: Arı haldeki X sıvısının mol kütlesi 62, oda sıcaklığındaki yoğunluğu 1,1g/mL dir. Aynı sıcaklıkta bu sıvının 31ml siile 250 ml sulu çözelti hazırlanıyor.
Bu çözeltideki X in molar derişimi kaçtır?
A) 3,1 B) 2,2 C) 1,1 D) 0,55 E) 0,25
1999 ÖSS

ÖRNEK: KNO3 ün, hacimleri ve sıcaklıkları eşit olan üç sıvıda çözünebilen miktarları (m) aşağıdaki gibidir:
Arı su : m1
Derişimi 1 M olan KNO3 çözeltisi : m2
Derişimi 1M olan NaNO3 çözeltisi : m3
Buna göre, m1, m2, m3 arasında nasıl bir ilişki vardır?
Yanıt E
Çözeltilerin Fiziksel Özellikleri
- Çözeltilerde iyon derişimi arttıkça saf çözücüye göre kaynama noktası yükselir, buhar basıncı azalır.
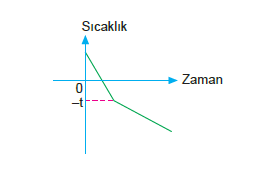
Doymamış bir çözelti ısıtılırsa doygunluğa ulaşana kadar kaynama noktası yükselir. 100 + t noktasında kaynama başlar. A noktasında çözelti doymamıştır.
B noktasında ise çözelti doygunluğa ulaşmıştır. Kayna- ma devam eder. Suyun buharlaşmasıyla çözünen çökmesi meydana gelir.
A– B arasında ve sonrasında kaynama olduğundan bu- har basıncı sabit ve dış basınca eşittir.
Kaynama noktası yükselmesi grafiğine göre, çözeltinin kaynaması (100 + t)°C de başlar.
- Kaynama noktası artarken donma noktası düşer. Bu olay donma noktası düşmesi olarak yorumlanır.
NOT: Kışın yolların buzlanmasına engel olmak için tuzlama, araba sularının donmaması için antifriz kullanılması çözeltilerin kaynama noktasının düşmesinden kaynaklanır.
X uçucu olmayan bir katı olduğuna göre,
1. X in doymamış sulu çözeltisi
2. X in doymuş sulu çözeltisi
3. Arı su
sıvılarının aynı ortamda kaynamaya başlama sıcaklıkları, sırasıyla T1, T2, T3 arasında nasıl bir ilişki vardır?
Yanıt E
ÖRNEK: Ağzı açık iki kaptan birinde arı su, diğerinde yemek tuzunun doymamış sulu çözeltisi kaynatılmaktadır.
Kaynama süresince,
I. derişim
II. hacim
III. sıcaklık
niceliklerinden hangilerinin arı suda değişmeyip tuz- lu suda değişmesi beklenir?
A) Yalnız I B) Yalnız III C) I ve III D) II ve III E) I, II ve III
2003 ÖSS
ÇÖZÜM: Saf maddelerde kaynama süresine sıcaklık sabitken çö- zeltilerde doygunluk sağlanana kadar kaynama noktası yükselmesi (sıcaklık artışı) devam eder. Bu esnada deri- şim artar, buharlaşmadan dolayı hacim azalır. Saf mad- delerde ise derişim söz konusu değildir ancak buharlaşmadan dolayı hacim sabit kalmaz, azalır.
Yanıt C

güzel bir site teşekkürlerr